Bienvenid@ a la Extranet para el manejo seguro de amoníaco.
¿Ya está registrad@? Para participar debe ingresar a una sesión, escribir el nombre y la clave de acceso con las que originalmente se registró y "conectarse" a nuestra red de trabajo.
¿Olvido su clave?
Si desea contribuir y todavía no dispone de nombre y contraseña de participación regístrese como miembro de esta comunidad virtual, ó contacte directamente al administrador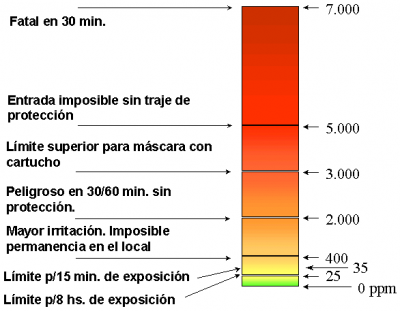

¿Ya está registrad@? Para participar debe ingresar a una sesión, escribir el nombre y la clave de acceso con las que originalmente se registró y "conectarse" a nuestra red de trabajo.
¿Olvido su clave?
Si desea contribuir y todavía no dispone de nombre y contraseña de participación regístrese como miembro de esta comunidad virtual, ó contacte directamente al administrador
Peligros del amoníaco para la salud:

Al manipular utilice traje protector:

¿Que es el amoníaco anhidro?
A una concentracion de mil ppm o superior, es asfixiante y quema las vias respiratorias, produce quemadura y destruccion de los tejidos como efecto de congelamiento (-28°c) y de su corrosidad (hidroliza mucosas y los tejidos blandos haciendolos muy susceptibles a infecciones).
El amoniaco era conocido por los antiguos, quienes lo obtuvieron a partir de la sal amónica, producida por destilación del estiércol de camello cerca del templo de Júpiter Amón en Libia, y de ahí su nombre. En Europa, durante la edad media, el amoniaco se obtenía calentando los cuernos y pezuñas de bueyes, y se llamaba espíritu de cuerno de ciervo. El alquimista alemán Basil Valentine obtuvo el amoniaco libre, y el químico francés Claude Berthollet determinó su composición en torno a 1777.
En el siglo XIX, la principal fuente de amoniaco fue la destilación de la hulla; era un derivado importante en la fabricación de los combustibles gaseosos. Hoy, la mayoría del amoniaco se produce sintéticamente a partir de hidrógeno y nitrógeno por el proceso de Haber, que consiste en pasar una mezcla estequiométrica de hidrógeno y nitrógeno a través de un lecho catalizador, formado principalmente por óxidos de hierro, en el que se mantiene una temperatura de unos 500ºC, pues, aun empleando catalizadores, la velocidad es muy lenta a temperaturas inferiores y no es rentable económicamente. La reacción es reversible y exotérmica. Los procesos industriales actuales utilizan como materia prima el aire atmosférico para el nitrógeno y los hidrocarburos, y para el hidrógeno, principalmente gas metano o hidrocarburos obtenidos de procesos de refino del petróleo
El amoniaco es un refrigerante importante y se usa mucho en la industria química, especialmente en la fabricación de fertilizantes, ácido nítrico y explosivos. La mayor parte de éste se utiliza para la fabricación de ácido nítrico, como ya hemos visto anteriormente, de abonos nitrogenados compuestos, que contienen además fosfatos y sales potásicas. También se consume gran cantidad de amoniaco en diversas industrias orgánicas, de colorantes, plásticos, drogas, etc., y una pequeña parte como líquido de refrigeración de máquinas frigoríficas.
Amo, G, a)mmo/j, arena : Según Plinio en el desierto de Libia bajo las arenas había una sal ( cloruro amónico). Libia era celebre por el templo de Amón (nombre egipcio de Júpiter). Ejemplo: amoniaco. Dicen que el amoniaco se descubrió en las cuadras de los caballos de los peregrinos que iban al templo de Zeus Amón.
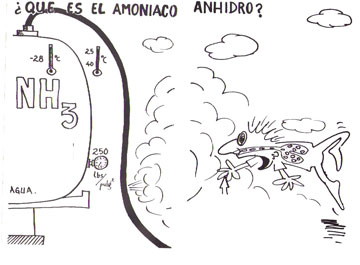 |
El amoníaco anhidro es un gas incoloro de olor picante e irritante y muy soluble en agua. Una disolución acuosa saturada contiene un 45% en peso de amoniaco a 0ºC y un 30% a temperatura ambiente. Disuelto en agua, el amoniaco se convierte en hidróxido de amonio, de marcado carácter básico y similar en su comportamiento químico a los hidróxidos de los materiales alcalinos. |
A una concentracion de mil ppm o superior, es asfixiante y quema las vias respiratorias, produce quemadura y destruccion de los tejidos como efecto de congelamiento (-28°c) y de su corrosidad (hidroliza mucosas y los tejidos blandos haciendolos muy susceptibles a infecciones).
El amoniaco era conocido por los antiguos, quienes lo obtuvieron a partir de la sal amónica, producida por destilación del estiércol de camello cerca del templo de Júpiter Amón en Libia, y de ahí su nombre. En Europa, durante la edad media, el amoniaco se obtenía calentando los cuernos y pezuñas de bueyes, y se llamaba espíritu de cuerno de ciervo. El alquimista alemán Basil Valentine obtuvo el amoniaco libre, y el químico francés Claude Berthollet determinó su composición en torno a 1777.
En el siglo XIX, la principal fuente de amoniaco fue la destilación de la hulla; era un derivado importante en la fabricación de los combustibles gaseosos. Hoy, la mayoría del amoniaco se produce sintéticamente a partir de hidrógeno y nitrógeno por el proceso de Haber, que consiste en pasar una mezcla estequiométrica de hidrógeno y nitrógeno a través de un lecho catalizador, formado principalmente por óxidos de hierro, en el que se mantiene una temperatura de unos 500ºC, pues, aun empleando catalizadores, la velocidad es muy lenta a temperaturas inferiores y no es rentable económicamente. La reacción es reversible y exotérmica. Los procesos industriales actuales utilizan como materia prima el aire atmosférico para el nitrógeno y los hidrocarburos, y para el hidrógeno, principalmente gas metano o hidrocarburos obtenidos de procesos de refino del petróleo
El amoniaco es un refrigerante importante y se usa mucho en la industria química, especialmente en la fabricación de fertilizantes, ácido nítrico y explosivos. La mayor parte de éste se utiliza para la fabricación de ácido nítrico, como ya hemos visto anteriormente, de abonos nitrogenados compuestos, que contienen además fosfatos y sales potásicas. También se consume gran cantidad de amoniaco en diversas industrias orgánicas, de colorantes, plásticos, drogas, etc., y una pequeña parte como líquido de refrigeración de máquinas frigoríficas.
Amo, G, a)mmo/j, arena : Según Plinio en el desierto de Libia bajo las arenas había una sal ( cloruro amónico). Libia era celebre por el templo de Amón (nombre egipcio de Júpiter). Ejemplo: amoniaco. Dicen que el amoniaco se descubrió en las cuadras de los caballos de los peregrinos que iban al templo de Zeus Amón.
| por: click (lunes 14.05.2007@19:07h) | (0 Comentarios) Comentar |